
Por dentro dos Biossimilares
A ciência por trás dos Biossimilares – Qual o racional empregado para seu desenvolvimento.
O propósito central a ser seguido quando se desenvolve um biossimilar é o de que o paciente se beneficie exatamente do mesmo perfil de segurança e eficácia obtido com o uso do produto inovador referência. É exatamente a clareza em relação a esse propósito, que garantirá o sucesso do planejamento de seu desenvolvimento e da consequente obtenção de um produto altamente biossimilar a um produto referência, apto a ter sua comercialização aprovada por agências reguladoras comprometidas com a saúde e segurança da população.
Nesse sentido, para se garantir sucesso na obtenção de alta biossimilaridade durante o desenvolvimento é importante que algumas estratégias sejam adotadas. Essas práticas integram o que podemos aqui chamar de “racional para desenvolvimento de um biossimilar”, descrito a seguir e esquematizado na Figura 6.
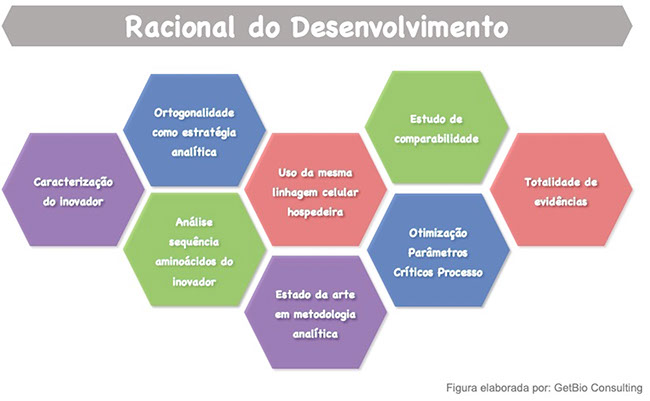
Figura 6 - Racional do desenvolvimento de biossimilares. As principais estratégias para se aumentar as chances de garantir a biossimilaridade de um produto candidato a biossimilar.
Figura elaborada por: GetBio Consulting.
Abaixo descreveremos brevemente as principais estratégias adotadas com vistas a se obter um produto biológico altamente biossimilar a seu produto referência.
A. Conhecer a fundo o produto referência: como o objetivo principal no desenvolvimento de um produto biossimilar é obter um produto o mais similar possível a um determinado produto referência inovador, o primeiro passo é estudar esse produto referência em detalhes. Diferentes lotes desse produto são analisados para se avaliar uma série de propriedades físico-químicas, estruturais e biológicas (características relevantes para a segurança e eficácia de seu uso). Essa análise de diversos lotes, garantirá que se defina, para cada propriedade analisada, o quanto ela varia de lote a lote. Ao longo do desenvolvimento do biossimilar, características críticas para segurança e eficácia do produto deverão ser comparadas às do produto inovador e os resultados das análises feitas com o biossimilar deverão permanecer dentro dos limites de variabilidade observadas para diferentes lotes do inovador.
B. Análise da sequência de aminoácidos: como já discutido no item “Entendendo os Medicamentos Biológicos”, os produtos dessa categoria de medicamentos, obtidos por rota biotecnológica, são proteínas. Proteínas têm como menor unidade estrutural, componentes bioquímicos chamados de aminoácidos. A sequência de aminoácidos de uma proteína é fundamental para que ela adquira a conformação espacial que garantirá sua função e a forma como será distribuída no organismo humano (ou seja, como chegará ao alvo e depois como será eliminada do organismo). Nesse contexto, a sequência de aminoácidos de um biossimilar precisa ser idêntica à sequência de aminoácidos do produto referência. Para se garantir isso, se faz uma análise da sequência de aminoácidos do produto inovador. O próximo passo é inserir na célula que vai produzir essa proteína biossimilar, um código (gene) para essa célula produza exatamente a mesma sequência de aminoácidos do produto inovador. Esse gene é sintetizado e inserido artificialmente na célula escolhida (chamada de “linhagem de célula hospedeira”). Desta forma, a célula passa a sintetizar a proteína biossimilar desejada com mesma sequência de aminoácidos do produto inovador referência, garantindo, à proteína, a mesma conformação espacial e função do inovador.
C. Uso de métodos integrados (métodos ortogonais): devido à alta complexidade dessas moléculas, muitas vezes é necessária a utilização de mais de um método analítico para avaliar a fundo uma mesma propriedade físico-química, estrutural ou biológica e para eventualmente avaliar questões que um ou outro método não consegue avaliar plenamente. Essa estratégia fortalece grandemente a segurança em torno da comparabilidade entre biossimilar e inovador fornecendo maior robustez aos resultados;
D. Estado-da-Arte em metodologias analíticas: O uso de métodos modernos e atuais de alta sensibilidade, capazes de detectar mínimas diferenças entre candidato a biossimilar e inovador é vital para o sucesso da demonstração da biossimilaridade durante o exercício de comparabilidade in vitro, ou seja, em laboratório.
E. Célula Hospedeira semelhante à adotada pelo desenvolvedor do produto referência: o perfil de glicosilação de uma proteína recombinante (ou perfil de açúcares ancorados à proteína) é uma das características essenciais para garantir adequada função e segurança dessa proteína, porque impacta em propriedades ligadas diretamente à eficácia e à segurança do medicamento biológico. Diferentes células hospedeiras (células onde se insere o gene que representa o código para a célula produzir a molécula ativa do produto biológico), oriundas de diferentes tecidos e espécies animais, glicosilam suas proteínas de forma diferente. Como o desenvolvedor de biossimilares quer obter o mesmo “perfil de glicosilação”, para ter um produto com mesma eficácia e segurança, comparativamente ao produto inovador, o ideal é adotar linhagem de célula hospedeira semelhante à empregada pelo desenvolvedor do inovador.
F. Desenvolvimento do Processo – durante todo o desenvolvimento dos processos de multiplicação celular e produção da molécula recombinante (Upstream processing), bem como dos processos de recuperação e purificação da molécula (Downstream processing) até a etapa de formulação do produto final, deve-se empregar o produto referência como modelo para o desenvolvimento do produto biossimilar. Informações sobre o processo de produção do produto referência não são conhecidas; desta forma, a estratégia que geralmente se adota é definir algumas propriedades específicas do produto referência para nortear esse desenvolvimento. As especificações para essas propriedades são empregadas como critérios de aceitação a serem adotados em cada etapa do desenvolvimento dos processos de produção;
G. Comparabilidade Lado a Lado: assim que finalizado o desenvolvimento de todas as etapas do processo de produção, com obtenção de um produto com perfil de biossimilaridade dentro do esperado, define-se todas as condições operacionais a serem seguidas para a produção do biossimilar com a qualidade desejada. São então produzidos alguns lotes nessas condições, tanto para prova de consistência do processo de produção, como para adotar os lotes em um estudo de comparabilidade lado a lado, para prova de biossimilaridade in vitro entre produto inovador e biossimilar. O número de lotes a ser analisado (do inovador e do lote comercial do biossimilar) deve ser alinhado com a agência reguladora e dependerá do conhecimento levantado ao longo do histórico de uso do produto inovador, do conhecimento adquirido ao longo do desenvolvimento do biossimilar e da variabilidade do método analítico Uma adequada análise estatística deve ser apresentada para garantia da biossimilaridade com base nos resultados desse estudo de comparabilidade;
H. Totalidade de evidências: os protocolos dos estudos não clínicos (em animais) comparativos e de estudos clínicos (em humanos) comparativos devem ser desenhados com foco em resolver dúvidas residuais, ou seja, aquelas dúvidas não esclarecidas durante o exercício de comparabilidade dos produtos in vitro (em laboratório), em relação ao potencial impacto de diferenças observadas entre produto biossimilar e referência sobre segurança, eficácia e imunogenicidade.
I. Diálogo constante com autoridade reguladora: é de suma importância que haja uma relação estreita com a agência reguladora, desde o início do desenvolvimento de biossimilares, para alinhamentos periódicos em relação à coerência da condução do desenvolvimento, passo a passo, desde seu planejamento. Esta aproximação visa evitar surpresas ao longo do caminho que possam demandar retrabalho ou levar a exigências não previstas, que poderiam gerar um aumento do custo do desenvolvimento, ou mesmo, em casos extremos, inviabilizar o projeto.
ALTERAR!
aguardando informações
2020 - Desenvolvido pela Conteúdo Comunicação