
Por dentro dos Biossimilares
Exigências Regulatórias: como os biossimilares são aprovados para comercialização e regulados no Brasil?
A diretriz adotada pela agência reguladora brasileira, ANIVSA, para registro de medicamentos biológicos, dentre os quais os biossimilares é a RDC 55/2010(3). Nessa resolução, a via de desenvolvimento relacionada aos biossimilares é a via de desenvolvimento por comparabilidade. Além dessa diretriz normativa, a ANVISA também lançou em 2011 um guia que orienta sobre o exercício de comparabilidade(16) e outro que trata da elaboração de relatórios de estudos clínicos(17).
Somados a essa diretriz e guias, outras normas devem ser seguidas para produção, uso e comercialização desses produtos, formando o arcabouço regulatório esquematizado na Figura 7.
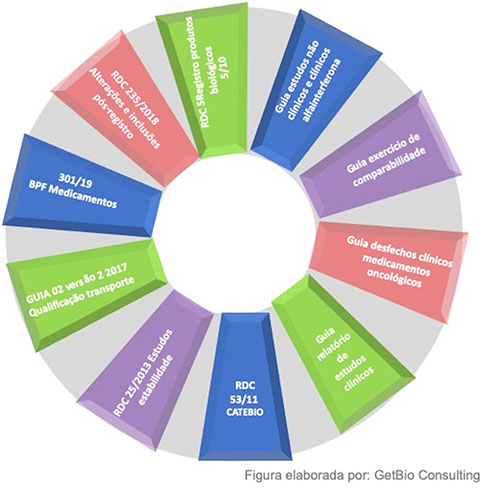
Figura 7 - Arcabouço regulatório para o registro de medicamentos biológicos e biossimilares no Brasil.
Adotando essas normas, a ANVISA consegue avaliar alguns aspectos relevantes para garantir que o produto biossimilar tenha a qualidade desejada e com isso tenha mesmo perfil de segurança e eficácia que o produto comparador (inovador referência). De uma forma geral, os principais pontos avaliados para um biossimilar, além daqueles já observados para outros medicamentos, são a prova de biossimilaridade em termos de qualidade, segurança, eficácia e imunogenicidade, que é garantida por meio de estudos discutidos no item “A ciência por trás dos Biossimilares – Qual o racional empregado para seu desenvolvimento”, desse website.
–
3. ANVISA. RESOLUÇÃO - RDC Nº 55, DE 16 DE DEZEMBRO DE 2010. BVSMS. [Online] 16 de 12 de 2010. [Citado em: ] http://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2010/anexo/anexo_res0055_16_12_2010.pdf.
16. ANVISA. Guia para realização do exercício de comparabilidade para registro de produtos biológicos. [Online] 2011. http://portal.anvisa.gov.br/documents/33836/351410/Guia+para+Realização+do+Exerc%C3%ADcio+de+Comparabilidade+para+Registro+de+Produtos+Biológicos/af64c771-df3e-42a4-88ae-ba60c07d2113.
17. Guia para Elaboração de Relatórios de Estudos Clínicos para fins de Registro e/ou Alterações Pós-registro de Produtos Biológicos. [Online] 2011. http://portal.anvisa.gov.br/documents/33880/3062236/Relatório+Estudos+Cl%C3%ADnicos+Produtos+Biológicos/7b43fc7e-0251-4671-a340-5c4bb22a193f.
ALTERAR!
aguardando informações
2020 - Desenvolvido pela Conteúdo Comunicação