Entendendo sobre Medicamentos Biológicos
Como são desenvolvidos os medicamentos biológicos obtidos por rota biotecnológica?
Na década de 1970, teve início a era da Biotecnologia moderna, caracterizada pelo desenvolvimento e aplicação da tecnologia do DNA recombinante que permite que um material genético retirado de um organismo, ou preparado sinteticamente, seja artificialmente introduzido no genoma (conjunto de genes) de um outro organismo (denominado por isso de organismo hospedeiro). Essa poderosa ferramenta foi e continua sendo essencial para o desenvolvimento dos medicamentos biológicos complexos. Vamos entender melhor essa ferramenta e como ela é empregada para se obter os medicamentos biológicos recombinantes?
Primeiramente, para se entender como funciona essa ferramenta e sua utilidade, é importante saber que um gene (que é um fragmento de DNA) possui o código para se produzir uma proteína.
Dito isso, vamos conhecer como se desenvolve um medicamento biológico, utilizando a tecnologia do DNA recombinante. Esse processo tem início com a escolha do organismo ou célula hospedeira, ou seja, um organismo, ou célula, que será modificado geneticamente para sintetizar a proteína terapêutica de interesse. Essa escolha dependerá do tipo de proteína que se deseja desenvolver e de suas características moleculares, podendo ser usados microrganismos, animais, plantas, ou ainda células desses organismos maiores. Definido o organismo hospedeiro, parte-se para a etapa de obtenção do gene que possui o código para síntese da proteína de interesse. Esse gene é artificialmente introduzido no organismo hospedeiro, sendo “recombinado” ao seu material genético, como se fizesse parte dele e dando a esse organismo ou célula a competência para produzir a proteína codificada pelo gene de interesse, como uma proteína recombinante(6).
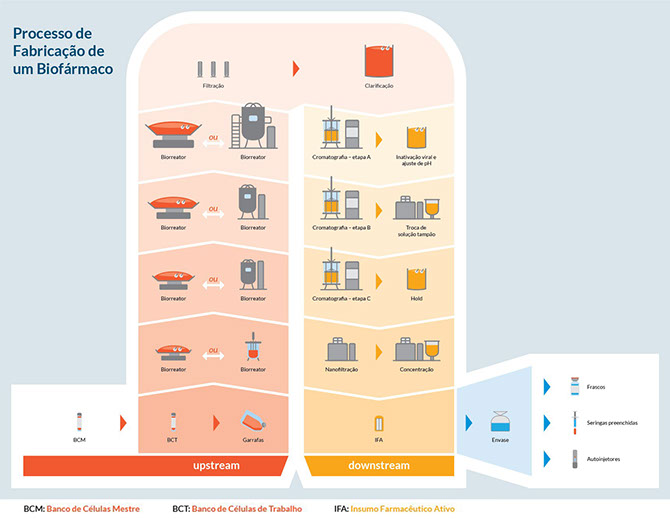
Quando são utilizadas células para o desenvolvimento de uma proteína recombinante, após a inserção do DNA codificador dessa proteína nas células, algumas técnicas são utilizadas para se isolar aquelas células que incorporaram o DNA de interesse e que estão produzindo corretamente e em grande quantidade a proteína de interesse. Uma vez identificada e selecionada a célula ideal, são fornecidas condições para que ela se multiplique a fim de formar uma população de células idênticas que carregam o mesmo material genético recombinado. Essa população é então congelada, formando o chamado Banco de Células, composto por diversos microtubos congelados que devem ser armazenados a baixíssimas temperaturas, visando preservar as propriedades que garantirão às células ali estocadas, a capacidade de, ao serem recondicionadas à temperatura ambiente, produzirem as proteínas de interesse sempre com a mesma qualidade.
Uma vez desenvolvida a linhagem celular recombinante e estabelecidos os Bancos de Células, passa-se para o desenvolvimento do processo de produção. São fornecidas, a essas células vivas, condições de cultivo adequadas para que possam produzir e secretar as proteínas terapêuticas recombinantes. Para isso, as células desenvolvidas e armazenadas nos Bancos de Células são descongeladas, e se inicia o cultivo das mesmas em pequena escala, sendo essa escala progressivamente aumentada até que se alcance uma escala ideal de produção, em um biorreator.
A terceira etapa de produção a ser desenvolvida envolve a recuperação e purificação da proteína recombinante do meio de cultivo metabolizado utilizado no biorreator durante o processo de produção. Para isso, são utilizados diferentes e sequenciais métodos de filtração e de cromatografia preparativa. A última etapa a ser desenvolvida é a de formulação e envase.
Como parte do desenvolvimento de um novo medicamento, é essencial a condução de estudos não-clínicos in vitro e in vivo. Esses estudos visam avaliar se o produto é seguro para ser utilizado em humanos e se o produto exibe uma atividade farmacológica que justifique seu desenvolvimento(7).
As respostas obtidas nos estudos não-clínicos sobre as características do produto e sobre sua relação com a segurança em animais embasarão a decisão do desenvolvedor pela continuidade dos estudos. Se os resultados forem positivos, o medicamento iniciará então sua fase de estudos clínicos, onde será avaliada a interação dele com o organismo humano.
Os estudos clínicos são divididos em fases, cada uma delas apresentando características e objetivos específicos(8).
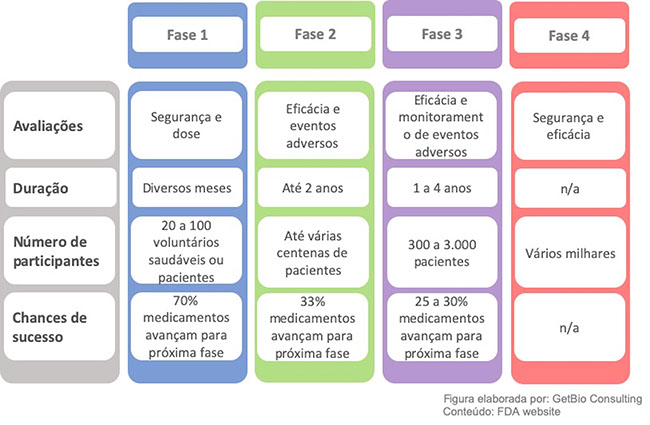
Diferentes etapas dos estudos clínicos, as avaliações realizadas a cada etapa, estimativas de tempo de duração, de número de pacientes e das chances de sucesso.
–
6. Science History Institute. Science History. [Online] [Citado em: ] https://www.sciencehistory.org/historical-profile/herbert-w-boyer-and-stanley-n-cohen.
7. EMA. ICH S6 (R1) Preclinical safety evaluation of biotechnology-derived pharmaceuticals. [Online] 30 de 09 de 1997. https://www.ema.europa.eu/en/ich-s6-r1-preclinical-safety-evaluation-biotechnology-derived-pharmaceuticals.
8. FDA. FDA Step 3: Clinical Research . [Online] FDA. https://www.fda.gov/ForPatients/Approvals/Drugs/ucm405622.htm.
2020 - Desenvolvido pela Conteúdo Comunicação